







|
|
|
|
|
||
В системах, внутри которых протекают физические, химические, биологические процессы, всегда производится энтропия. Это производство происходит с определенной скоростью
Производство энтропии в единицу времени diS/d![]() в единице объема V открытой системы обозначим буквой
в единице объема V открытой системы обозначим буквой ![]() по данному определению
по данному определению
Величина ![]() называется функцией диссипации*.
называется функцией диссипации*.
Обратим внимание на вторую принципиальную особенность введенную в рассуждения - появилось время, т. к. определяется скорость производства энтропии. Напомним, что первая принципиальная особенность состояла в возможности убывания энтропии dS<0 в открытой системе. Итак, совершен переход от термостатики, которой являлась классическая термодинамика к меняющимся во времени процессам, т.е. к динамике, к кинетике. Термостатика рассматривает равновесные процессы, т.е. протекающие очень медленно, где на каждом этапе достигается равновесие. Выше в формулах (1) и (2) совершен переход к неравновесным процессам.
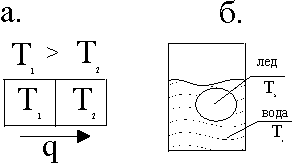
На рисунке рассмотрены два приведенных в соприкосновение тела при разных температурах. От более нагретого тела к менее нагретому из-за теплопроводности возникает поток теплоты, производится энтропия dS=dQ/T. Движущей силой в производстве энтропии является разность температур (T1-T2). Как будет показано ниже эту разность удобно представить в форме
"Сконструируем" функцию диссипации в виде
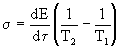 (3)
(3)В этой формуле отражены все элементы процесса производства энтропии: поток энергии dE/d![]() и движущая сила, создающая этот поток. В рассматриваемом случае движущей силой является разность температур. Заметим, что E является энергией, приходящейся на единицу объема [E] =Дж/м3.
и движущая сила, создающая этот поток. В рассматриваемом случае движущей силой является разность температур. Заметим, что E является энергией, приходящейся на единицу объема [E] =Дж/м3.
Рассмотрим размерности правой и левой частей формулы (3). По определению размерность функции диссипации [![]() ]=
]=![]() , а размерность правой части формулы (3)
, а размерность правой части формулы (3) ![]() , т. е. с размерностью все в порядке.
, т. е. с размерностью все в порядке.
Можно привести второе определение функции диссипации:
Функция диссипации равна произведению потока J на силу Х, его вызывающую: ![]() =J*Х
=J*Х
Возможно построить функцию диссипации не только для тепловых явлений.
Например, для электрических явлений потоком является сила электрического тока I, а вызывающей его силой - разность потенциалов (![]() 1-
1- ![]() 2) и
2) и ![]()
![]() I (
I (![]() 1-
1-![]() 2). Электрический ток I=de/d
2). Электрический ток I=de/d![]() - производная заряда по времени [I(
- производная заряда по времени [I(![]() 1-
1- ![]() 2)] =Вт=Дж/c. Из соображений размерности следует брать удельную электрическую мощность Дж/см3 и поделить ее на температуру, т. е.
2)] =Вт=Дж/c. Из соображений размерности следует брать удельную электрическую мощность Дж/см3 и поделить ее на температуру, т. е.
Если в системе протекает химическая реакция, то также производится энтропия. Химическая реакция течет от большей свободной энергии к меньшей. Роль действующей силы играет разность химических потенциалов А, а потока - скорость химической реакции V, т. е. число молей вещества, испытывающих превращение в единицу времени. По указанным выше правилам "конструируем" функцию диссипации:
Во всех перечисленных случаях реализуются необратимые процессы. Выше функция диссипации ![]() везде была представлена как произведение потока J на силу X, его вызывающую.
везде была представлена как произведение потока J на силу X, его вызывающую.
Читателю рекомендуется так же ознакомтся с параграфом Сопряженные процессы в открытых системах и примерами к главе Термодинамика открытых систем и живые организмы
В заключение отметим, что в этом разделе кратко изложены работы основателей термодинамики необратимых процессов Л. Онзагера, Де Донде и И. Пригожина, которые в 1977 г. за работы по термодинамике необратимых процессов и их использование в химии и биологии были удостоены Нобелевской премии.
И. Пригожин (1917) - бельгийский физик, член Бельгийской АН, директор Международного института физики и химии (Бельгия), член АН СССР, ввел понятия производство энтропии и поток энтропии, дал локальную формулировку второго начала ТД, сформулировал теорему Пригожина, автор многих монографий по неравновесной термодинамике.
Л. Онзагер (1903 - 1976) - американский химик и физик, профессор химии ряда американских университетов. В 1931 г. доказал ряд теорем термодинамики необратимых процесaсов.