







|
|
|
|
|
||
Вдали от равновесия возникают диссипативные пространственные и временные структуры, т. е. образуется неравновесный порядок. Иногда такой порядок состоит в появлении колебаний и волн, например, в химических диссипативных системах. Особенно ярко этот эффект проявился в так называемой реакции Белоусова- Жаботинского (БЖ): в стакан налита розовая жидкость, в которую из пипетки подаются капли бесцветной жидкости и раствор в стакане через 1 мин становится голубым, еще через минуту жидкость сама становится снова розовой и т. д. (рис. 1). Возникают как бы химические часы.
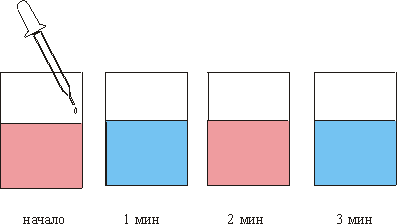
Это явление было открыто в 1951 г. химиком- экспериментатором Б. П. Белоусовым, комбригом в отставке, зав. лабораторией в институте Биофизики. Позднее, в 1959 г. А. М. Жаботинский детально изучил эту реакцию и дал качественное ее объяснение. Математическое моделирование подобных процессов в 1970 г. провел в Англии Тьюринг. За совокупность исследований реакций рассматриваемого типа Б. П. Белоусов и А. М. Жаботинский были удостоены в 1980 г. Ленинской премии. Такова краткая история, связанная с всемирно известной реакцией БЖ, а теперь обратимся к химическому механизму этого явления.
В упрощенной схеме реакция Белоусова состоит из двух стадий. В первой стадии трехвалентный церий Ce3+ (розовый цвет) окисляется бромноватой кислотой HBrО3, что приводит к избытку ионов Се4+ (голубой цвет):
Во второй стадии четырехвалентный церий Се4+ восстанавливается органическим соединением - малоновой кислотой (МК), т. е.
и голубой цвет сменяется розовым. Этот процесс так и продолжается: розовый, голубой, розовый, голубой и т. д. с периодичностью, равной 1 мин (рис. 2). Периодический процесс прекращается после большого числа периодов из-за необратимого расходования бромата BrO3.
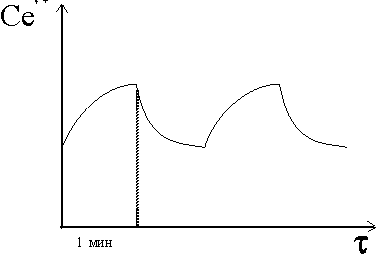
Жаботинский описал широкий класс химических волновых явлений, в которых наблюдалась пространственно-временная упорядоченность. При этом были реализованы как одномерные реакции в тонких трубках, так и двухмерные процессы (тонкие слои раствора между пластинами).
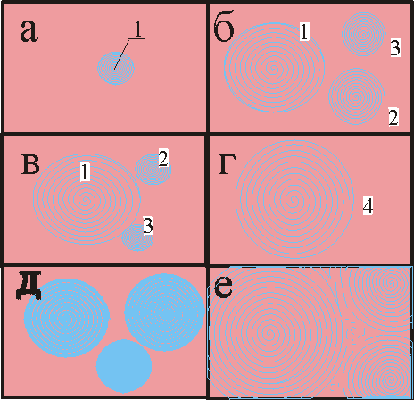 Рис. 3. Последовательные кадры волновых химических процессов в тонких слоях раствора (двумерные системы).
Рис. 3. Последовательные кадры волновых химических процессов в тонких слоях раствора (двумерные системы).
На рис. 3 показано развитие волны при плоской реализации явления: сначала (а) возникает центр 1 изменения окраски, он появляется из-за локальной флуктуации концентрации; одновременно (б) возникают и новые концентрационные центры 2 и 3, последние потом могут быть поглощены (в) волнами от центра 1 и способствовать развитию (г) волновой концентрационной структуры 4. Возможен вариант (д и е) появления более сложной картины от многих начальных центров.
Пространственно-временная упорядоченность может рассматриваться как автоколебательные и автоволновые процессы. Эти процессы поддерживаются за счет оттока энтропии из системы. При этом могут образовываться спиральные волны, они носят название ревербераторов. Такого типа образования довольно часто встречаются в биологических системах, например, в строении лишайников.
В работах И. Пригожина подчеркивается связь между физико-химическими процессами в открытых неравновесных процессах и биологической упорядоченностью.