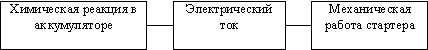|
|
|
|
|
||
Если системе сообщается теплота dQ и ею производится работа dW, то согласно первому началу термодинамики
На основании второго начала термодинамики для обратимых систем
Объединяя уравнения (1) и (2), получаем:
Величина
Максимально полезная работа, производимая системой при постоянном объеме, равна убыли свободной энергии Гельмгольца
Если рассматривать процессы, протекающие при постоянном давлении, то надо учесть работу pdV против постоянного давления. Тогда для практического применения остается лишь работа
Соотношение (3) справедливо не только для механической работы pdV расширения газов, но и для любых видов работы (работы электрического тока или химических реакций и др.).
Для примера приведем блок-схему процессов, протекающих в автомобильном аккумуляторе и приводящих стартер в движение: