







|
|
|
|
|
||
Рассмотрим три примера:
Пример 1. Сгорание водорода и образование воды
Пример 2. Образование окиси азота
Пример 3. Плавление кристалла и испарение жидкости
Пример 1. Сгорание водорода и образование воды
Рассмотрим химическую реакцию окисления при сгорании водорода и образовании воды
Происходит понижение свободной энергии газов ![]() G < 0 и ее выделение в форме тепла 236760 Дж/моль при образовании воды. Понижение свободной энергии - необходимое условие химической реакции, но это условие недостаточное: термодинамика лишь говорит, что процесс может пойти или не пойти.
G < 0 и ее выделение в форме тепла 236760 Дж/моль при образовании воды. Понижение свободной энергии - необходимое условие химической реакции, но это условие недостаточное: термодинамика лишь говорит, что процесс может пойти или не пойти.
Пример 2. Образование окиси азота
Рассмотрим реакцию соединения кислорода O2 с азотом N2
в обычных условиях не пойдет, т. к. ![]() G<0, а обратная реакция
G<0, а обратная реакция
идет с понижением свободной энергии ![]() G<0, т. е. она принципиально возможна.
G<0, т. е. она принципиально возможна.
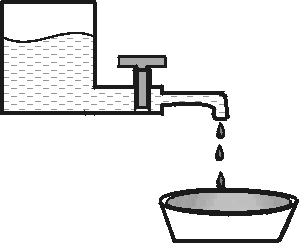
Модель такой реакции приведена на рис. 1. Термодинамика говорит, что рано или поздно жидкость из верхнего сосуда перетечет в нижний сосуд, т. е. жидкость течет не вверх, а вниз. Условие достаточное моделируется краном: если он закрыт, то процесс не реализуется сколь угодно долго, хотя положение верхней жидкости термодинамически не равновесно.
Пример 3. Плавление кристалла и испарение жидкости
На рис. 2 изображена замкнутая система, в которой благодаря поглощаемому теплу кристаллы льда превращаются в газ. В первом сосуде лед при t=0oC начинает плавиться, и температура при этом не меняется; дальше нагревается вода до t=100oC (p=1 атм.), температура далее не повышается, пока вода не превратится в пар. Для воды теплота плавления Hпл=6000 Дж/моль; теплота парообразования Hпар =40000 Дж/моль, т. е. Hпар>Hпл.
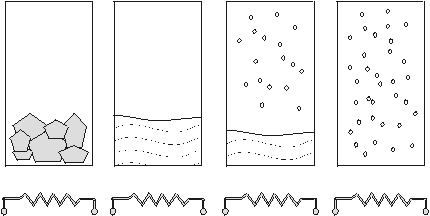
Плавление льда "энтропийно выгодный" процесс, т. к. неупорядоченное состояние атомов более вероятно, чем упорядоченное, поэтому энтропия жидкости (ж) и кристалла (кр) подчиняется неравенству Sж>Sкр, однако Hж<Hкр . Чтобы расплавить кристалл, надо разорвать часть межмолекулярных связей.
Состояние газа (г) более вероятно, чем состояние жидкости, но Hг>Hж.
Найдем термодинамическое условие фазового перехода от кристалла к жидкости
Из этой зависимости найдем температуру плавления
Найдем ![]() S для воды и пара
S для воды и пара
Если бы изменение энтропии кристалла и жидкости совпадали бы, т. е. ![]() S = 0, то Тпл стремится к бесконечности и плавления не было бы.
S = 0, то Тпл стремится к бесконечности и плавления не было бы.
Изменение энтропии при фазовом переходе определяет саму возможность фазовых переходов. Не было бы изменения энтропии - не было бы нашего мира.
Повторим, что в гигантской фабрике естественных процессов природы энтропия выполняет роль директора, который предписывает вид и течение всех сделок, а закон сохранения энергии занимает место бухгалтера, который приводит в равновесие дебет и кредит.